北京市大兴区中关村科技园区大兴生物医药产业基地
奥信阳光首个新药获批临床

北京市大兴区中关村科技园区大兴生物医药产业基地
2015年,国务院印发《关于改革药品医疗器械审评审批制度的意见》,提出开展药品上市许可持有人制度(MAH)试点工作;
2017年,CFDA公布《中华人民共和国药品管理法修正案(草案征求意见稿)》,在总则之后增加了第五条规定:国家实行药品上市许可持有人制度。明确释放即将全国推行的信号;
2020年7月,新《药品注册管理办法》和《药品生产监督管理办法》正式实施并全面落实药品上市许可持有人制度……
MAH制度的出台,使得药品上市许可与生产许可分离,不但鼓励了国内医药行业的创新发展,还让诸多的CDMO企业收获了巨大的商业机会。
“让科学家安心做研发,让企业家专注做生产,让经营商专注做市场”曾有业内人士这样评价MAH制度。
一场医药领域的颠覆性改革问世7年,MAH制度如何改变中国医药界?行业面临哪些机遇与挑战?
催生产物
一直以来,基于国内医药行业发展基础差、底子薄等特点,出于监管的考虑,国内采用的是上市许可与生产许可“捆绑”制度。
经过几十年发展,“黄金有价药无价”时代一去不复返,医药行业发生翻天覆地的变化:
Biotch“后浪”崛起,如雨后春笋般涌现;一大批Biopharma创新药企也不甘落后,国内创新力量逐渐壮大、不可小觑。
据英国Informa集团的《2022医药研发趋势年度分析》白皮书数据:截至2022年1月,全球药物研发管线达到20109个,中国位居第二,药品研发数量占全球总量的20.8%,为4189个。[1]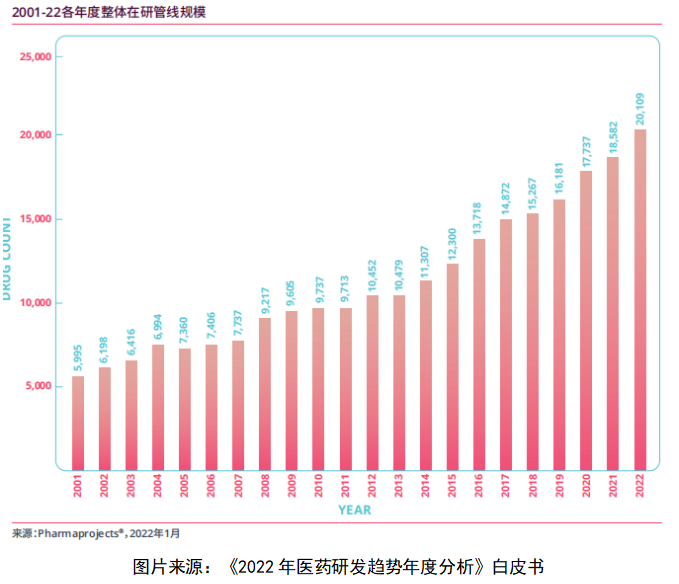
再加之,源源不断的资本进入医药行业,加速了行业巨变。
Biotch创新崛起,但缺乏生产力量;药厂则缺乏品种生产、面临低水平重复问题,造成资源浪费。
此时,MAH制度呼之欲出。
2015年,在国内医药改革大刀阔斧进入“深水区”背景下,提出开展MAH制度试点工作。
发展历程
事实上,MAH制度早已是国际通用的制度之一。
在欧盟,采取的是上市管理分离制度,MAH可以自行生产,也可以将产品委托给不同的生产商生产。
而美国,任何有条件的主体,都可以向FDA申报,生产者的单独规定是不限制MAH来同时担任药品生产商。
2005年,日本也采取了上市和生产分离的上市许可制度,但日本要求有一个MAH准入前提,只有拿到行政许可资格以后,才可以进行药品的上市申请。
中国直到2015年,才引入了该制度。
据悉,药品上市许可持有人(Marketing Authorization Holder,MAH)制度,通常指拥有药品技术的药品研发机构、科研人员、药品生产企业等主体,通过提出药品上市许可申请并获得药品上市许可批件,并对药品质量在其整个生命周期内承担主要责任的制度。
值得注意的是,在该制度下,上市许可持有人和生产许可持有人可以是同一主体,也可以是两个相互独立的主体。根据自身状况,上市许可持有人可以自行生产,也可以委托其他生产企业进行生产。
如果委托生产,上市许可持有人依法对药品的安全性、有效性和质量可控性负全责,生产企业则依照委托生产合同的规定就药品质量对上市许可持有人负责。
也就是说,国内正以药品上市许可持有人制度试点为突破口,由上市许可与生产许可的“捆绑制”,向上市许可与生产许可分离转型。[2]
MAH制度的出现,使得研发机构、自然人等不具备相应生产资质的主体,得以通过合作或委托生产的方式获得药品上市许可,有效保护了其研发积极性,同时也有利于减少重复建设、提高产能利用率。
困境渐显
自2020年,新《药品注册管理办法》正式实施以来,全面落实MAH制度已有近两年的时间。
在解决市场痛点、促进企业发展的同时,全面落实MAH制度困境渐显。
技术泄露风险
MAH制度的实施,让科研人员能够拥有品种,专心做研发,生产可以委托出去。对于生产厂家来说,不用再费一大笔钱去做研发,使得各自分工更具体,“专业人做专业事”。
但在委托过程中,研发企业持有人最关心和优先考量的因素有哪些?
据国家药品监督管理局高级研修学院汤涵等在对24家具有研发业务的医药企业进行了调研后发现:产品的专利保护或关键物料的掌控能力,以及受托方的知识产权(商业秘密)保护力度是研发企业最为关注的。[4]
由此可见,在研发企业委托过程中,对于生产企业的培训或交流,不可避免造成技术泄露、知识产权纠纷等风险。
研发水平参差不齐
MAH制度出台后,国内一大批MAH持牌公司涌现,但真正能够自主开展完成制剂/API的小试、中试放大、技术转移、工艺验证、注册申报等药品研发工作,并具备各期临床研究和注册服务能力的公司较少。
特别是关于研发体系、质量管理体系、项目管理体系、合规体系等建设,包括药品全生命周期的药物警戒体系、不良反应监控等,机构设置、人员配备等方面存在欠缺。
在立项方面,医保谈判、集采政策高举“降价”大旗,让带金销售暴露在阳光下无处可藏,仿制药面临生死大考;而创新药,则面临靶点同质化内卷,蓝海“秒变”红海苦不堪言。
如何找到二者之间的平衡点,尤其重要。
MAH新选择
在国内MAH制度迅猛发展之时,如何把握发展良机,避开仿制药“降价潮”和创新药的“内卷潮”,从而切实享受政策红利期?
一家专注改良型新药研发的MAH持有人公司——奥信阳光出现了。
奥信阳光(北京)药业科技有限公司(以下简称“奥信阳光”),在北京市大兴生物医药基地,由多名世界前五强制药企业高级科学家归国创立,共分三期建设,总投资1.2亿人民币。
据悉,奥信阳光致力于成为国内首批专注于改良型新药技术开发的MAH型研发公司,设有合成、分析、制剂、专利等技术研究部门,并拥有国内药物研发领域知名专家、重点院校博士、硕士等高学历技术型人才。
作为一家全自主能力的改良型新药MAH公司,奥信阳光拥有众多优势:
聚焦于改良型创新药的MAH公司;
能自主开展完成制剂/API的小试、中试放大、技术转移、工艺验证、注册申报等药品研发工作;
具备各期临床研究及注册服务能力;
拥有特色原料药/医药中间体的开发能力及生产能力;
拥有自主知识产权的口服固化超分子载体制剂平台,及创新超分子宿主材料合成技术。
目前,奥信阳光拥有多项国际领先的制剂、分析、合成技术专利,专注于改良型新药开发及成果转化,已成功转化了多个1类创新药,2类改良型新药;并且完成了包括独家仿制药在内的多个技术壁垒项目的申报。
长期固定合作服务于近20个中国制药行业前100强大型企业,并与美国著名学府宾夕法尼亚大学医学院、美国德雷克塞尔大学公共卫生学院、广州暨南大学药学院、沈阳药科大学等国内外知名学术研究机构长期保持技术交流合作。
参考资料:
[1]《全球在研新药,5图盘点》,赛柏蓝,张自然博士,2022-5-18
[2]《药品上市许可持有人制度》,国家食药总局官网,2017-01-03
[3]你不知道的药品上市许可持有人制度(MAH)细节解读,生物谷,2016-10-25
[4]汤涵,王敏娇,王文,等.药品研发企业开展MAH委托生产的影响因素研究[J].中国医药工业杂志,2020年51卷10期,1329-1333页,2020.
奥信阳光首个新药获批临床
奥信阳光深耕改良型新药领域引潮流